2. 北京永新医疗设备有限公司, 北京 102206
2. Beijing Novel Medical Equipment Co., Ltd., Beijing 102206, China
单光子发射计算机断层扫描(single-photon emission computed tomography, SPECT)成像系统作为核医学影像诊断的基础设备之一,具有临床诊断药物种类丰富、适应证广泛和检查费用低等优点,在临床方面应用广泛[1-2]。而核医学影像诊断技术中,SPECT优势不断凸显也引领学者逐渐聚焦SPECT定量技术研究。SPECT定量可为疾病治疗前后的纵向评估和核素治疗前后的剂量学评估提供依据[3]。由于传统单机的SPECT成像系统无法进行衰减校正,因此SPECT仍被认为是非定量的显像方式[4]。随着SPECT/CT成像系统推出和相应定量重建算法的提出,二者为实现SPECT定量奠定了坚实基础,推动SPECT进入定量时代,这对进一步推广SPECT的临床应用具有重要意义[5-8]。
Insight NM/CT Pro成像系统由北京永新医疗设备有限公司研制,为可变角双探头的SPECT/CT一体机。系统采用全数字化探测器设计,可以在大视野内获得更好的空间分辨率、能量分辨率和计数率特性,并可以在探测器性能出现波动时实现参数自动标定和更新。除了优异的探测器性能,该系统还提出一种改进的有序子集最大期望值迭代法(ordered subsets expectation maximization, OSEM),用于实现高性能SPECT成像。通过线追踪方式分析单个探测单元在投影域的反投影构建系统模型,实现射线追踪与衰减校正运算同步,并结合GPU并行加速技术,有效解决了SPECT图像重建速度慢和定量精度不准确等问题[9]。
GE Discovery NM/CT 670是目前国际先进SPECT/CT成像系统,采用碘化钠(NaI)晶体探测器,探头最大计数率特性可达4.6×105 s-1,固有能量分辨率为9.5%@140 keV,系统空间分辨率为7.4 mm[10]。本文通过与GE Discovery NM/CT 670成像系统对比,评估了国产Insight NM/CT Pro成像系统的定量成像准确性。基于YY/T 1546—2017《用于SPECT成像CT衰减校正的试验方法》[11]和NEMA NU 1—2018《Gamma相机的性能测量》[12]2个标准的相关性能评估要求,对比2个不同成像系统对放射性核素锝-99 m(99mTc)的衰减精度和定量精度。
1 材料与方法 1.1 系统简介Insight NM/CT Pro成像系统实物如图 1所示。系统采用可变角双探头设计,每个探头由平面尺寸为540.0 mm × 400.0 mm的NaI晶体、以铅合金制成的准直器和光电倍增管组成,探头最大计数率特性达5.6×105 s-1,固有能量分辨率为9.8 %@140 keV,系统空间分辨率为7.3 mm。低能高分(low energy high resolution, LEHR)准直器内部由排列规则的六边形平行孔组成。每个孔长为35.0 mm,孔壁厚度为0.2 mm,孔直径为1.5 mm。
|
| 图 1 Insight NM/CT Pro成像系统实物 |
本研究对Insight NM/CT Pro和GE Discovery NM/CT 670成像系统设置相同采集条件进行数据采集。采集条件如下:SPECT扫描时矩阵大小设置为256×256,双探头以H模式扫描,每个探头扫描范围为180°,步进3°,放大倍数为1,采用双能窗采集,主能窗为126~154 keV,低能窗为114~126 keV,扫描过程中启用轮廓跟踪;CT图像均采用轴扫,扫描范围为500 mm×500 mm,转速为1 r/s,高压为120 kV,电流为100 mA,以标准滤波器进行滤波反投影重建,重建矩阵大小为512×512。SPECT重建参数采用各系统默认参数,即GE Discovery NM/CT 670成像系统子集数为10,迭代次数为2,无后滤波;Insight NM/CT Pro成像系统子集数为4,迭代次数为10,无后滤波。2个不同成像系统均需进行空间分辨率恢复校正、散射校正和衰减校正,衰减校正过程使用的衰减图均由各系统重建后的CT图像转换获得。
1.2 定量标定定量标定是获取定量图像的关键步骤[13-14]。针对SPECT定量, 为准确获取定量转换因子,在进行定量精度测试前,需要先使用高为190 mm、内径为200 mm的圆柱体模型对系统进行定量因子标定[15-16]。首先,将99mTc溶液注入圆柱模型腔体内,并注意避免产生气泡;其次,分别采用Insight NM/CT Pro和GE Discovery NM/CT 670的LEHR准直器对模型进行数据采集,参数按1.1节所述设置;再次,SPECT数据采集完成后进行CT采集,采用双线性转化法将CT图像转化为SPECT对应核素能量下的衰减系数值,用于后续重建图像过程的衰减校正[17];最后,采用系统配套算法重建图像,重建过程需要充分考虑准直器模糊、散射和衰减等物理效应的影响,在重建图像中勾画感兴趣区域(volume of interest, VOI)用于定量标定因子计算。为确保定量标定因子的准确性,该VOI需要包含于圆柱体内部,且区域足够大。定量转换因子F表示如下:
| $ F=\frac{1000 C_{\mathrm{R}}}{a_{\text {true }} T P_X P_Y P_Z}, $ | (1) |
| $ a_{\text {true }}=\frac{\left[A_{\text {pre }}-A_{\text {post }}\left(\frac{1}{2}\right)^{\frac{t_{\text {post }}-t_{\text {pre }}}{t_{1 / 2}}}\right]\left(\frac{1}{2}\right)^{\frac{t_{\text {scan }}-t_{\text {pre }}}{t_{1 / 2}}}}{V} . $ | (2) |
其中:atrue为真实放射性活度浓度,计算时需要充分考虑核素随时间衰变的作用,Bq/mL;CR为重建图像VOI内的光子计数均值;T为单角度采集时间,s;PX、PY和PZ分别为X、Y和Z这3个方向的单像素大小,mm;Apre、Apost分别为注射前药物活度和注射后药物活度,Bq;V为模型中水的体积,cm3;tpre、tpost、tscan和t1/2分别为开始注药前时刻、注药后时刻、开始扫描时刻和核素半衰期,s。
1.3 模型试验SPECT/CT成像系统定量标定可实现图像定量转换。为评估系统的定量准确性,本文基于衰减精度模型和NEMA NU1—2018体模进行试验和分析,实物模型如图 2所示。

|
| 图 2 实物模型 |
1) 衰减精度模型试验。
衰减精度反映了重建图像与真实图像的吻合性,对定量精度的准确性具有重要影响。本研究根据YY/T 1546—2017[11]标准要求对系统衰减精度进行评估。衰减精度模型如图 2a所示,模型内为柱高185 mm且截面直径190 mm的圆柱体空腔,空腔内有3个截面直径为50 mm的圆柱形插入物,依次充满空气、水和接近骨密度的物质(如聚四氟乙烯等,以下该类物质均以“骨”命名),其余空腔部分注入与水充分混合均匀的99mTc液体((222.0±3.7) MBq)形成背景区域。对上述衰减精度模型进行SPECT/CT复合扫描和图像重建,并轴向加和图像后计算各插件相对误差Δinsert和衰减校正非均匀性NUAtt,分别表示如下:
| $ C_{\mathrm{N}}=\frac{1}{9} \sum\limits_{i=1}^9 C_i; $ | (3) |
| $ \varDelta_{\text {insert }}=\frac{C_{\text {insert }}}{C_{\mathrm{N}}} \times 100 \% ; $ | (4) |
| $ \mathrm{NU}_{\mathrm{Att}}=\left\{\begin{array}{l} +\frac{C_{i, \max }-C_{\mathrm{N}}}{C_{\mathrm{N}}} \times 100 \%, \\ -\frac{C_{\mathrm{N}}-C_{i, \min }}{C_{\mathrm{N}}} \times 100 \% . \end{array}\right. $ | (5) |
其中:Cinsert为插入物感兴趣区域(region of interest, ROI)内的光子计数均值;CN为归一化计数,即9个背景ROI内光子计数均值的平均值;Ci, max为9个背景ROI内光子计数均值的最大值,Ci, min为9个背景ROI内光子计数均值的最小值,Ci对应第i个背景ROI内的光子计数均值。
2) 定量精度。
为评估系统全身断层成像性能,本研究按照NEMA NU 1—2018[12]标准评估了SPECT系统的断层成像对比度和绝对定量精度。测验采用的NEMA NU 1—2018体模(见图 2b)由一副躯干模体、一副肺插件及6个直径依次为13、17、22、28、28和32 mm的球体插件组成,前4个球体注入含放射性药物溶液以形成“热区”小球,后2个球体注入清水以形成“冷区”小球。数据采集前,需配制适量与水充分混合均匀且靶本比为8∶1的99mTc溶液,并分别注入模型“热区”小球及空腔内,“冷区”小球注满清水即可。
按上述采集条件进行SPECT/CT扫描和图像重建后,分别计算各小球的定量恢复系数和图像对比度,以评估定量精度。以CT图像“热区”小球边缘为参考,绘制各“热区”小球和背景VOI,并计算小球的恢复系数RCs,表示如下:
| $ \mathrm{RC}_{\mathrm{s}}=\frac{a_{\text {measure }}}{a_{\text {true }}}. $ | (6) |
其中ameasure为小球VOI内的实际测量活度浓度均值。
根据NEMA NU1-2018[12]标准,在小球直径最大层(中心层)处勾画“热区”小球j、“冷区”小球k和背景ROI。计算不同j或k的对比度时,需在“热区”或“冷区”中勾画与j或k同等大小的ROI,在背景区域勾画12个与j或k同等大小的ROI。j的对比度Qhot,j和k的对比度Qcol,k分别表示如下:
| $ Q_{\text {hot }, j}=\frac{C_{\text {hot }, j} / C_{\text {bac, }, j}-1}{a_{\text {hot }} / a_{\text {bac }}-1} \times 100 \%, $ | (7) |
| $ Q_{\mathrm{col}, k}=\left(1-\frac{C_{\mathrm{col}, k}}{C_{\mathrm{bac}, k}}\right) \times 100 \% \text {. } $ | (8) |
其中:Chot,j为j内ROI的光子计数均值,Cbac,j为与j同等大小的12个背景ROI内的光子计数均值,j=1,2,3,4;ahot为“热区”小球的真实活度浓度值,abac为背景区域的真实活度浓度值;Ccol,k为k内ROI的光子计数均值,Cbac,k为与k同等大小的12个背景ROI内的光子计数均值,k=1,2。
背景变化系数需在背景区域取5层图像数据,在每层图像中勾画12个与不同直径小球l同等大小的ROI。l对应直径分别为13、17、22、28和32 mm小球的编号,l=1,2,…,5。5层分别为中心层、轴向两侧距离中心层10 mm最近的层和轴向两侧距离中心层20 mm最近的层。l的背景变化系数PBVl表示如下:
| $ \mathrm{PBV}_l=\frac{\mathrm{SD}_l}{C_{\text {bac }, l}} \times 100 \%. $ | (9) |
其中:Cbac,l为背景区域中与l同等大小的60个ROI内光子计数均值的总平均值;SDl为背景区域中与l同等大小的60个ROI内光子计数均值的标准差。
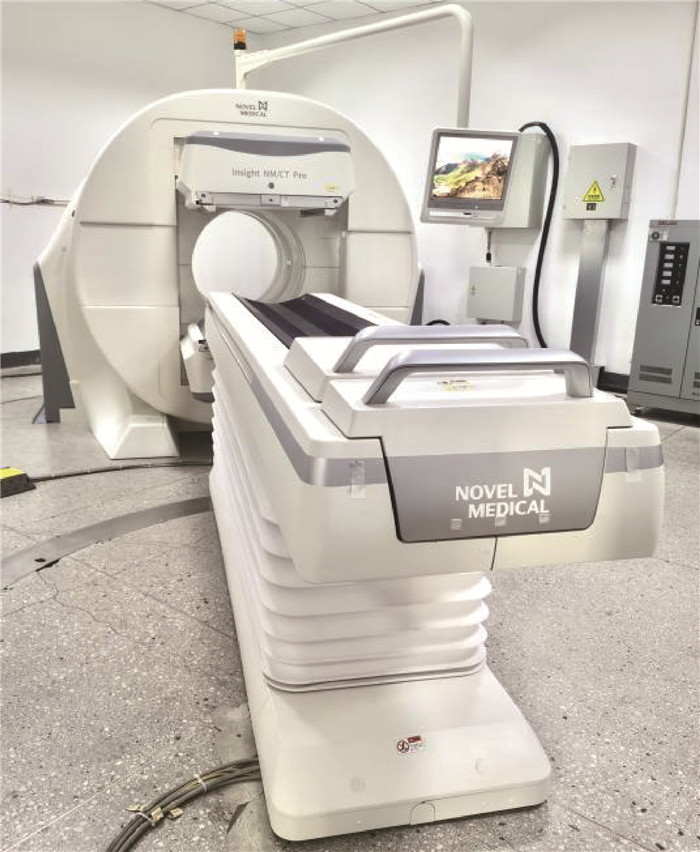
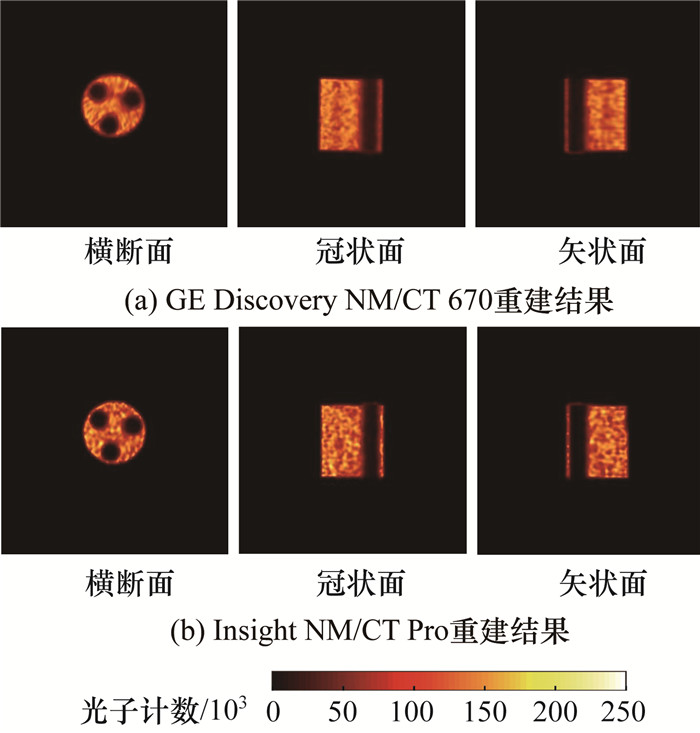
2 实验结果与分析 2.1 衰减精度测试图 3为不同成像系统衰减精度模型的重建结果对比。对重建图像进行轴向加和,分别在模型背景区域内和插入物内部勾画VOI,按1.3节所述方法计算衰减精度,结果如表 1所示,加和图和VOI勾画示意图如图 4所示。
|
| 图 3 不同成像系统衰减精度模型的重建结果对比 |
| % | |||||||||||||||||||||||||||||
| 成像系统 | 空气衰减相对误差 | 水衰减相对误差 | 骨衰减相对误差 | NUAtt(正向) | NUAtt(负向) | ||||||||||||||||||||||||
| GE Discovery NM/CT 670 | 16.64 | 18.01 | 11.02 | 3.56 | -5.98 | ||||||||||||||||||||||||
| Insight NM/CT Pro | 7.84 | 8.38 | 4.66 | 4.00 | -3.22 | ||||||||||||||||||||||||
|
| 图 4 衰减精度模型轴向加和图和VOI勾画示意图 |
2.2 定量精度测试
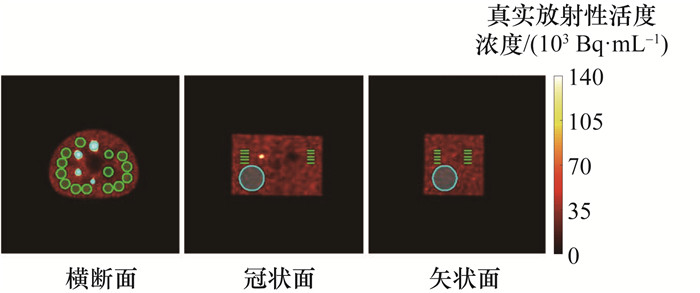
图 5为不同成像系统NEMA NU 1—2018体模定量重建结果对比。可以看出,在同一层面上,GE Discovery NM/CT 670的定量重建图像中“冷区”小球和肺插件部位的边缘相对模糊,且与背景区域的对比度相差较小;而Insight NM/CT Pro的定量重建图像中“冷区”小球和肺插件部位的边缘相对清晰,与背景区域的对比度相差较大,表明其更能展现真实放射性活度浓度。

|
| 图 5 不同成像系统的NEMA NU 1—2018体模定量重建结果对比 |
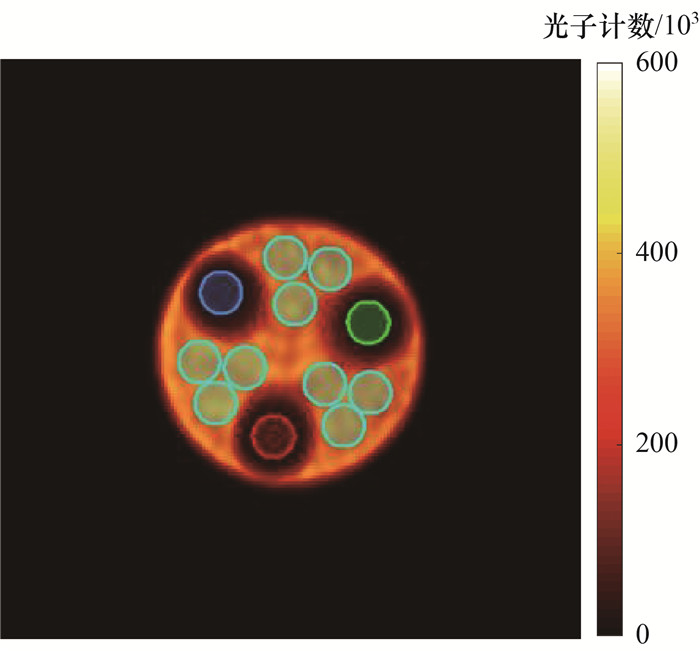
按式(2)计算各“热区”小球内真实活度,在GE Discovery NM/CT 670定量重建图像和Insight NM/CT Pro定量重建图像上勾画相同区域的VOI,如图 6所示,蓝色圆框标记部分为实际计算的VOI,绿色圆框标记部分为实际计算的ROI,其中仅展示了“冷区”ROI和12个直径为32 mm的背景ROI。计算直径为13、17、22、28 mm“热区”小球和模型背景区域的真实放射性活度浓度,由式(6)—(9)计算2个不同成像系统的定量恢复系数、对比度和背景变化系数,结果如表 2—4所示。2个不同成像系统的定量恢复系数(直径为13、17、22和28 mm“热区”小球)分别为:GE Discovery NM/CT 670系统为31.04%、51.36%、59.91%和66.39%;Insight NM/CT Pro系统为38.22%、50.98%、66.55% 和71.32%。对于背景浓度偏差,GE Discovery NM/CT 670系统为10.84%,Insight NM/CT Pro系统为7.95%。
|
| 图 6 NEMA NU 1—2018体模ROI和VOI勾画示意图 |
| % | |||||||||||||||||||||||||||||
| 成像系统 | 小球直径/mm | ||||||||||||||||||||||||||||
| 13 | 17 | 22 | 28 | ||||||||||||||||||||||||||
| GE Discovery NM/CT 670 | 31.04 | 51.36 | 59.91 | 66.39 | |||||||||||||||||||||||||
| Insight NM/CT Pro | 38.22 | 50.98 | 66.55 | 71.32 | |||||||||||||||||||||||||
| % | |||||||||||||||||||||||||||||
| 成像系统 | 小球直径/mm | ||||||||||||||||||||||||||||
| “热区” | “冷区” | ||||||||||||||||||||||||||||
| 13 | 17 | 22 | 28 | 28 | 37 | ||||||||||||||||||||||||
| GE Discovery NM/CT 670 | 21.47 | 48.72 | 51.74 | 64.97 | 58.86 | 48.58 | |||||||||||||||||||||||
| Insight NM/CT Pro | 13.44 | 23.59 | 45.89 | 55.86 | 55.34 | 59.75 | |||||||||||||||||||||||
| % | |||||||||||||||||||||||||||||
| 成像系统 | 小球直径/mm | ||||||||||||||||||||||||||||
| 13 | 17 | 22 | 28 | 37 | |||||||||||||||||||||||||
| GE Discovery NM/CT 670 | 11.37 | 10.54 | 9.70 | 9.16 | 8.68 | ||||||||||||||||||||||||
| Insight NM/CT Pro | 7.22 | 6.43 | 5.74 | 5.14 | 4.54 | ||||||||||||||||||||||||
随着小球体积增大,图像恢复能力大幅提高,其中直径为28 mm的“热区”小球的定量恢复系数达71.32%;而直径为13和17 mm的“热区”小球相比直径为28 mm的“热区”小球定量恢复系数出现明显跌幅现象,说明Insight NM/CT Pro成像系统对较小病灶的定量准确性还有待提高。Insight NM/CT Pro成像系统的背景浓度偏差略小于GE Discovery NM/CT 670成像系统,说明2个不同成像系统的图像定量精度相近。
上述实验结果表明,2个不同成像系统的定量恢复系数和对比度均小于1,这是由部分容积效应(partial volume effects, PVE)引起的。由于SPECT成像系统空间分辨率有限,因此SPECT成像系统对小尺寸物体成像时无法较好恢复细节特征,从而影响图像定量精度。文[18]表明,对于容积为17~120 mL的容器,20%~40%的定量误差来源于PVE。SPECT成像系统的定量恢复系数越大,表明系统越能准确恢复真实的活度分布,即定量精度越高。
3 结论本文通过衰减精度和定量精度实验,对比分析了GE Discovery NM/CT 670和Insight NM/CT Pro 2个不同成像系统性能。实验结果表明:在相同采集条件和默认重建参数下,Insight NM/CT Pro成像系统获得的重建图像在均匀度及图像分辨率方面表现相对更优;定量模型图像中“热区”小球的定量恢复系数略高于GE Discovery NM/CT 670成像系统,且“冷区”小球的边缘更明显。由此验证,Insight NM/CT Pro成像系统定量性能与国际先进的GE Discovery NM/CT 670成像系统相近。
SPECT定量是从辐射剂量学层面实现放射性核素治疗个性化的重要先决条件。随着诊疗一体化放射性药物发展,SPECT定量时代加速到来。但精准的SPECT定量需要同时改进系统软件和硬件,除传统方法提供的校正方法外,还需要考虑系统运动导致的性能漂移、系统灵敏度测量,以及不同放射性核素、闪烁晶体厚度和准直器等引起的偏差。未来,精准、鲁棒的SPECT定量研究仍面临更多技术挑战。
| [1] |
MARIANI G, BRUSELLI L, KUWERT T, et al. A review on the clinical uses of SPECT/CT[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2010, 37(10): 1959-1985. DOI:10.1007/s00259-010-1390-8 |
| [2] |
BAILEY D L, WILLOWSON K P. An evidence-based review of quantitative SPECT imaging and potential clinical applications[J]. Journal of Nuclear Medicine, 2013, 54(1): 83-89. DOI:10.2967/jnumed.112.111476 |
| [3] |
DICKSON J, ROSS J, VÖÖ S. Quantitative SPECT: The time is now[J]. EJNMMI Physics, 2019, 6(1): 4. DOI:10.1186/s40658-019-0241-3 |
| [4] |
D'ASSELER Y. SPECT/CT and image quality[M]// GLAUDEMANS A, MEDEMA J, VAN ZANTEN A, et al. Quality in nuclear medicine. Cham: Springer, 2017: 179-192.
|
| [5] |
LJUNGBERG M, PRETORIUS P H. SPECT/CT: An update on technological developments and clinical applications[J]. The British Journal of Radiology, 2018, 91(1081): 20160402. DOI:10.1259/bjr.20160402 |
| [6] |
ZEINTL J, VIJA A H, YAHIL A, et al. Quantitative accuracy of clinical 99mTc SPECT/CT using ordered-subset expectation maximization with 3-dimensional resolution recovery, attenuation, and scatter correction[J]. Journal of Nuclear Medicine, 2010, 51(6): 921-928. DOI:10.2967/jnumed.109.071571 |
| [7] |
WIECZOREK H. SPECT image quality and quantification[C]// 2006 IEEE Nuclear Science Symposium Conference Record. San Diego, USA: IEEE, 2006: 2854-2858.
|
| [8] |
SHCHERBININ S, CELLER A, BELHOCINE T, et al. Accuracy of quantitative reconstructions in SPECT/CT imaging[J]. Physics in Medicine & Biology, 2008, 53(17): 4595-4604. |
| [9] |
CHENG L, LIU F, GAO L L, et al. An integrated framework of projection and attenuation correction for quantitative SPECT/CT reconstruction[C]// 2021 IEEE Nuclear Science Symposium and Medical Imaging Conference. Piscataway, USA: IEEE, 2021: 1-3.
|
| [10] |
HJELLSTRÖM M, ISAKSSON M. Medical gamma cameras in radiological emergency preparedness: Determination of calibration factors and MDA for the GE Discovery NM/CT 670 Pro[J]. Journal of Radiological Protection, 2023, 43(1): 011516. DOI:10.1088/1361-6498/acb9a4 |
| [11] |
中华人民共和国医药行业标准. 用于SPECT成像CT衰减校正的试验方法: YY/T 1546—2017[S]. 中国: 国家食品药品监督管理总局, 2017. Professional Standard of the People's Republic of China. Testing method for SPECT imaging based on CT-attenuation correction: YY/T 1546—2017[S]. Beijing: China Food and Drug Administration, 2017. (in Chinese) |
| [12] |
Notional Electrical Manufactures Association. Performance measurements of Gamma cameras: NEMA NU 1—2018[S]. Washington, D C: Notional Electrical Manufactures Association, 2018.
|
| [13] |
RITT P, VIJA H, HORNEGGER J, et al. Absolute quantification in SPECT[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2011, 38(S1): 69-77. DOI:10.1007/s00259-011-1770-8 |
| [14] |
DEWARAJA Y K, LJUNGBERG M, GREEN A J, et al. MIRD pamphlet No.24: Guidelines for quantitative 131I SPECT in dosimetry applications[J]. Journal of Nuclear Medicine, 2013, 54(12): 2182-2188. DOI:10.2967/jnumed.113.122390 |
| [15] |
PETERS S M B, VAN DER WERF N R, SEGBERS M, et al. Towards standardization of absolute SPECT/CT quantification: A multi-center and multi-vendor phantom study[J]. EJNMMI Physics, 2019, 6(1): 29. DOI:10.1186/s40658-019-0268-5 |
| [16] |
RITT P, KUWERT T. Quantitative SPECT/CT: Technique and clinical applications[M]// SCHOBER O, KIESSLING F, DEBUS J. Molecular imaging in oncology. Cham: Springer, 2020: 565-590.
|
| [17] |
刘帆, 高丽蕾, 程李, 等. 一种核医学图像定量重建方法: CN114119796A[P]. 2021-11-23. LIU F, GAO L L, CHENG L, et al. Quantitative reconstruction method for nuclear medicine image: CN114119796A[P]. 2021-11-23. (in Chinese) |
| [18] |
SHCHERBININ S, CELLER A. Assessment of the severity of partial volume effects and the performance of two template-based correction methods in a SPECT/CT phantom experiment[J]. Physics in Medicine & Biology, 2011, 56(16): 5355-5371. |



